左心房后壁射频消融后的迷走神经损伤——《Heart Rhythm》杂志中文版病例
病例简介
摘编自《Heart Rhythm》杂志中文版
程中伟 译 方全 校,北京协和医院
患者1,女性,47岁,氟卡胺和索他洛尔治疗无效的症状性心房颤动(AF)患者,在外院进行了左心房导管消融术。使用3.5 mm盐水灌注导管(NaviStar Thermo-Cool,Biosense Webster,Diamond Bar,CA),灌注速率17~30 ml/min,能量设定为35 W。在Lasso指导下隔离了全部4个肺静脉,在心腔内超声(ICE)指引下行冠状窦、二尖瓣环和高右房-上腔静脉交界区消融。报告中没有记录消融过程中阻抗的骤降、复杂的解剖或围手术期并发症,也没有记录在左心房后壁消融时患者有明显疼痛的感觉。但是,术后恢复饮食后患者主诉腹胀、束带样腹痛和过饱。
患者症状持续不缓解,随后腹部CT检查可见明显的胃扩张(图1A)。泛影葡胺(Bracco Diagnostics,Inc,Princeton,NJ)造影可见明显的胃扩张,但没有明显的梗阻(图1B)。心率也持续加快,平均心率从70次/min增加至90次/min。使用甲氧氯普胺(胃复安)、红霉素和多潘立酮治疗。患者症状逐渐缓解,能够进食少量、低脂食物,体重逐渐恢复。术后大约1年,患者停用胃肠动力药物后,仍有持续的轻度腹痛和腹胀。应用假饲法胰多肽反应评价迷走神经的完整性,结果表明,基础状态下胰多肽水平为44 pg/nl,20 min时达峰值55 pg/nl,随后10 min降至测不出的水平(<35 pg/nl)(图2)。胰多肽分泌的异常反应和峰值下降提示持续的迷走神经功能障碍。胃功能调节性研究表明平均比值为2.46,低于正常值(≥3)。这些辅助检查与轻度、永久性迷走神经损伤相一致。24 h Holter证实其平均心率为74次/min,恢复到消融术前的水平。
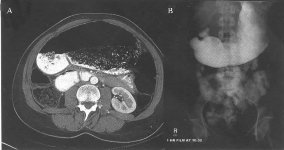
图1 A. 腹部增强CT示充满食物残渣的巨大胃扩张;B. 上消化道泛影葡胺造影示严重胃扩张,但没有明显的梗阻;
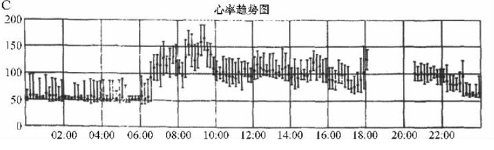
图1 C. 24 h Holter示清醒状态下窦性心率突然加快,持续一整天,仔细回顾分析ECG记录,符合窦性心动过速的诊断。
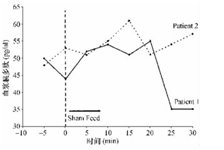
图2 患者1和2的胰多肽对假饲法的反应曲线
正常的反应为假饲后血浆胰多肽浓度增加25pg/nl。这2名患者的曲线提示迷走神经功能异常。
患者2,男性,16岁,因室上性心动过速在外院行导管消融术。术中使用5 mm消融导管对两种心律失常进行了消融,包括反复发作性交界区心动过速和房室结折返性心动过速。术中沿右心房后间隔和冠状窦内进行消融,具体消融时间和能量不清楚。
术后患者出现持续恶心、体位性头晕眼花和乏力。少量进食可减轻胃肠道症状。消融术后1个月,患者出现了慢性腹痛和频繁的绿色大便。
消融术后6个月,对患者再次评价,24 h Holter提示不适当窦性心动过速(图1C)。与患者1类似,假饲法胰多肽反应显示迷走神经的完整性受损,基础状态下血清胰多肽水平为48 pg/nl,15 min后达峰值至61 pg/nl,随后10 min降至57 pg/nl(图2)。胰多肽异常的反应和峰值提示持续的迷走神经功能障碍。胃功能调节性研究结果异常,平均比值为2.49。最后,使用锝99m标记的固体食物进行胃排空试验表明,胃排空时间延长超过4 h[1 h:47%(正常11%~39%),2 h:83%(正常40%~76%),4 h:100%(正常84%~98%)]。建议患者缓慢(每次20 min以上)多次(每天5~6次)进食,增加饮食中脂肪摄入量,汤中加入果胶增加浓度和使用复合糖类。随后6个月,患者胃部不适改善,但症状性窦性心动过速仍存在。
患者3,女性,51岁,房颤症状明显,既往应用普罗帕酮和三尖瓣峡部消融均无效,本次进行左心房导管消融术。术前行MRI和心内超声(ICE)了解食管定位。术前日服硫酸钡进一步明确食管的位置。使用3.5 mm盐水灌注导管(NaviStar ThermoCool,Biosense Webster),盐水灌注速度为17~30 ml/min,能量设定为30~35 W(左心房后壁消融时能量为30 W)。全部肺静脉成功电隔离,消融过程中未记录到阻抗骤降或左心房后壁消融时的明显疼痛症状。
消融术后3周,患者出现上腹胀、早饱和食欲明显下降。症状进展,出现恶心和体重下降约6.8 kg(15磅)。内镜可见食管远端和胃前庭的黏膜红斑。锝99m标记的固体食物排空试验表明胃排空延迟[60 min:27%,90 min:34%,120 min:57%(正常50%胃排空需88 min)]。给予患者胃复安治疗,同时建议少食多餐。3个月后,症状消失,体重恢复。随后停用胃复安,6个月时复查胃排空试验恢复正常。
临床评价
房颤消融术后早期可见自主神经系统的损伤。如果迷走神经介导的副交感神经系统受到损伤,患者会出现心率加快伴心率变异性降低。肺静脉外广泛消融的患者,自主神经的损伤可在消融术1年后出现。消融所致的部分迷走神经功能损伤对患者有益,可降低AF复发率,人和动物试验均已证实。但是,这里强调的是,神经损伤的程度非常重要,且介于有益和有害的治疗窗口非常窄。目前尚无确切的消融术式或方法能够预防神经损伤。进行针对降低或分离左心房电位的消融时应尽可能减少左心房消融能量和时间,减轻麻醉程度以识别早期疼痛,以及使用食管温度探针,但是以上方法均未证实有效。
关于迷走神经损伤后的胃肠道评价,初始要通过内镜或钡餐检查有无宿食,明确是否存在胃轻瘫(图1B)。以上两种方法有助于明确是否存在机械梗阻,以及提供是否存在幽门梗阻的线索。内镜也可帮助提供消融术后食管完整性的评价。实时MRI是一种较新的方法,可以明确胃动力、解剖情况,以及是否存在幽门梗阻。一项针对20名患者的研究表明,MRI诊断胃轻瘫和功能性幽门梗阻是可靠的方法。
胃排空扫描术是一种广泛使用且经济的方法,能够诊断是否存在胃淤滞及其严重程度。最后,像患者3那样,胃排空扫描术可以作为胃排空功能是否恢复,以及前后比较的方法。
消融术后胃轻瘫患者,应立即评价迷走神经功能的完整性。无创的评价方法包括胰多肽对假饲法的反应和诱导的低糖血症。典型的餐后胰多肽分泌呈双相,第一个峰值为迷走神经介导,发生在进食后10~30 min。第二个峰值出现在进食后30 min至6 h,并不完全依赖于迷走神经的刺激,主要是依赖肠道胰腺和神经激素的途径介导。第一个峰值的数值可以评价迷走神经的完整性和功能状况。
|
问题 1 该病的的治疗方法和诊疗要点有哪些?
答案:
治疗
迷走神经损伤诊断明确后,根据症状严重程度,治疗胃轻瘫和幽门痉挛(图3)。以少量、低脂饮食为主,禁止食用含有不易消化的纤维的食物。轻瘫患者使用胃肠动力药物可以提高肌肉的收缩性,改善症状。用以上方法处理后,仍有症状的患者需要更积极的治疗方法,比如幽门痉挛患者注射肉毒杆菌毒素,手术(胃切除术、胃造口术和空肠造瘘术)和使用起搏的方法刺激胃。有学者报道了4例严重的胃轻瘫和幽门痉挛患者,其中2例需要直接干预来缓解幽门痉挛[1名患者注射100UA型肉毒杆菌毒素(Botox,Allergan,Irvine,California),1名患者2次于内镜下行扩张术,随后进行了手术修复]。
病史
·腹痛和(或)腹胀
·恶心、呕吐
·早饱
·体重下降
体格检查
·心率加快(+/-)
·上腹膨胀和(或)触痛
·振水音
诊断性评价
·钡餐和(或)内镜
·或实时MRI(洧条件者)
·胃排空试验
·如果存在胃轻瘫和(或)幽门痉挛
·胰多肽分泌检查评价迷走神经的异常功能
治疗方案
·大部分患者随着时间的延长症状缓解
·少量、多次饮食方法保持体重
·胃轻瘫患者服用胃肠动力药物
·幽门痉挛患者可注射肉毒杆菌毒素
·症状无改善者应用手术方法、起搏
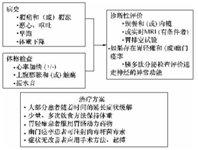
图3 房颤患者左心房射频消融术后疑诊迷走神经损伤者的评价流程和治疗方案
结果
3例患者中,1例完全恢复;患者2症状轻微,主要采用饮食调整的方法;患者3虽然胃部不适基本缓解,但仍存在持续有症状的不适宜窦性心动过速。Shah等曾报道4例房颤消融术后迷走神经损伤患者,2例完全恢复,但是另外2例像上面提到的那样,由于严重幽门痉挛需要积极干预措施。总共4例(57%)患者在没有干预的情况下恢复较好。
结论
当前采用的左心房后壁消融策略存在迷走神经损伤的风险。无创方法可以助于对胃轻瘫、幽门痉挛和迷走神经损伤作出诊断。早期诊断对治疗非常重要,它可以减少体重过度下降和减轻胃肠道症状。饮食、药物以及有创方法(有需要时)确实能缓解症状,大部分患者的症状可以逐渐得到明显缓解。
射频消融后迷走神经损伤简介
多种心律失常的治疗需要在左心房后壁进行射频消融术。心房颤动(房颤)患者更需要在左心房后壁进行广泛的消融,特别是针对复杂碎裂电位(CFAE电位)的消融或自主神经节的透壁消融。已有文献报道这种消融方式可导致心房-食管瘘的发生。
迷走神经走行于左心房后面,因此也非常容易受到损伤(图4)。迷走神经分支形成单一的神经束,经食管后壁进入腹腔,支配腹腔神经丛、胃、小网膜和肝。迷走神经损伤引起的病理生理改变取决于迷走神经损伤的部位及其下游支配的脏器,比如窦房结、房室结、肺静脉和心肌。迷走神经激动可引起窦房结和心室频率减慢,以及使房颤容易被诱发。迷走神经进入心脏的区域或之前部位受到消融损伤,将引起心率加快和降低房颤的可诱发性。在胃肠道,迷走神经控制胃肠蠕动、幽门括约肌的松弛和胃前庭的动力。支配这些脏器的迷走神经损伤后,可导致胃轻瘫和幽门括约肌痉挛,表现为腹胀、腹痛、恶心、早饱或容易过饱,以及体重下降。
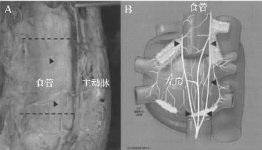
图4 A. 尸体上沿后纵隔与食管交界处的切面 为了暴露食管的前面,已经去除了心脏。没有去除沿食管分布的心包后壁,以免迷走神经纤维走行紊乱。标记了食管和降主动脉。虚线区域为与左心房后壁接触的食管区域。很多迷走神经纤维(箭头所示)穿过与左心房消融相接触的食管前壁。B.左心房与走行于其下面的冠状窦、气管和主支气管、食管以及迷走神经(箭头)的相对位置关系 迷走神经密集分布于肺静脉、左心房和心脏神经节。右侧迷走神经损伤更容易影响窦房结(与左侧迷走神经损伤比较),而左侧迷走神经损害更容易影响房室结。左心房左侧在迷走神经没有汇合形成后纤维束前损伤,可以影响下游的全部胃肠道脏器。
参考文献
- Haissaguerre M,Shah DC,Talahashi A,et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. Circulation 1998;98:835-838.
- Hou Y,Scherlag BJ,Lin J,et al. Ganglionated plexi modulate extrinsic cardiac autonomic nerve input:effects on sinus rate,atrioventricular conduction,refractoriness,and inducibility of atrial fibrillation. J Am Coll Cardiol 2007;50:61-68.
- Lin J,Scherlag BJ,Zhou J,et al. Autonomic mechanism to explain complex fractionated atrial electrograms(CFAE). J Cardiovasc Electrophysiol 2007;18:1197-1205.
- Nademanee K,McKenzie J,Kosar E,et al. A new approach for catheter ablation of atrial fibrillation:mapping of the electrophysiologic substrate. J Am Coll Cardiol 2004;43:2044-2053.
- Bunch TJ,Nelson J,Foley T,et al. Temporary esophageal stenting allows bealing of esophageal perforations following atrial fibrillation ablation procedures. J Cardiovasc Electrophysiol 2006;17:435-439.
- Pappone C,Oral H,Santinelli V,et al. Atrio-esophageal fistula as a complication of percutaneous transcatheter ablation of atrial fibrillation. Circulation 2004;109:327-334.
- Scanavacca MI,D’Avila A,Parga J,et al. Left atrial-esophageal fistula following radiofrequency catheter ablation of atrial fibrillation. J Cardiovase Electrophysiol 2004;15:960-962.
- Gray H. The Vagus Nerve. In:Lewis WH,ed. Anatomy of the Human Body. 20th ed. Philadelphia:Lea & Febiger,1918:Online Edition,2000.
- Ho SY,Cabrera JA,Sanchez-Quintana D. Vagaries of the vagus nerve:relevance to ablationists. J Cardiovasc Electrophysiol 2006;17:330-331.
- Ueno T,Uemura K,Harris MB,et al. Role of vagus nerve in postprandial antropyloric coordination in conscious dogs. Am J Physiol Gastrointest Liver Physiol 2005;288:G487-495.
- Hoogerwerf WA,Pasricha PJ,Kalloo AN,et al. Pain:the overlooked symptom in gastroparesis. Am J Gastroenterol 1999;94:1029-1033.
- Pisani CF,Hachul D,Sosa E,et al. Gastric hypomotility following epicardial vagal denervation ablation to treat atrial fibrillation. J Cardiovasc Electrophysiol 2008;19:211-213.
- Shah D,Dumonceau JM,Burri H,et al. Acute pyloric spasm and gastric hypomotility:an extracardiac adverse effect of percutaneous radiofrequency ablation for atrial fibrillation. J Am Coll Cardiol 2005;46:327-330.
- Hsieh MH,Chiou CW,Wen ZC,et al. Alterations of heart rate variability after radiofrequency catheter ablation of focal atrial fibrillation originating from pulmonary veins. Circulation 1999;100:2237-2243.
- Bauer A,Deisenhofer J,Schneider R,et al. Effects of circumferential or segmental pulmonary vein ablation for paroxysmal atrial fibrillation on cardiac autonomic function. Heart Rhythm 2006;3:1428-1435.
- Scanavacca M,Pisani CF,Hachul D,et al. Selective atrial vagal denervation guided by evoked vagal reflex to treat patients with paroxysmal atrial fibrillation. Circulation 2006;114:876-885.
- Schauete P,Scherlag BJ,Pitha J,et al. Catheter ablation of cardiac autonomic nerves for prevention of vagal atrial fibrillation. Circulation 2000;102:2774-2780.
- Ajaj W,Goehde SC,Papanikolaou N,et al. Real time high resolution magnetic resonanoe imaging for the assessment of gastric motility disorders. Gut 2004;53:1256-1561.
- Thomforde GM,Camilleri M,Phillips SF,et al. Evaluation of an inexpensive screening scintigraphic test of gastric emptying. J Nucl Med 1995;36:93-96.
- Schwartz TW,Rehfeld JF,Stadil F,et al. Pancreatic-polypeptide response to food in duodenal-ulcer patients before and after vagotomy. Lancet 1976;1:1102-1105.
- Schwartz TW,Grotzinger U,Schoon IM,et al. Vagovagal stimulation of pancreatic-polypeptide secretion by graded distention of the gastric fundus and antrum in man. Digestion 1979;19:307-314.
- Schwartz TW,Stenquist B,Olbe L. Cephalic phase of pancreatic-polypeptide secretion studied by sham feeding in man. Scand J Gastroenterol 1979;14:313-320.
- Jones MP,Maganti K. A systematic review of surgical therapy for gastroparesis. Am J Gastroenterol 2003;98:2122-2129.
- Dumonceau JM,Giostra E,Bech C,et al. Acute delayed gastric emptying after ablation of atrial fibrillation:treatment with botulinum toxin injection. Endoscopy 2006;38:543.
本病例来自《Heart Rhythm》杂志中文版(《心律》)。《Heart Rhythm》创刊于2004年,是心律学会(Heart Rhythm Society)和心脏电生理学会(Cardiac Electrophysiology Society)两个著名国际心电学会的官方杂志,由爱思唯尔出版。《Heart Rhythm》杂志中文版由郭继鸿主编,北京大学医学出版社出版。
|